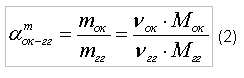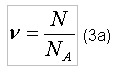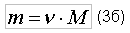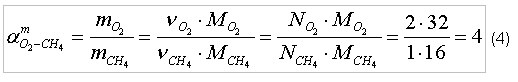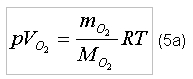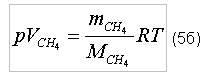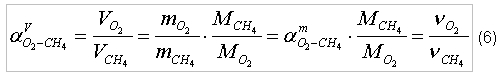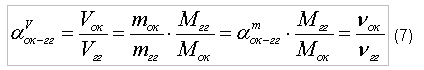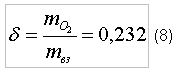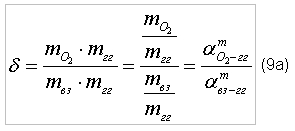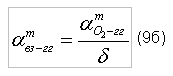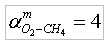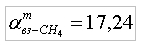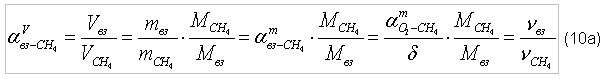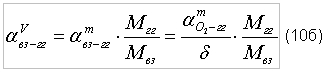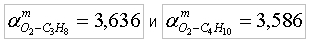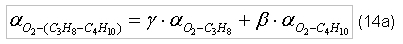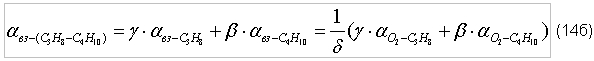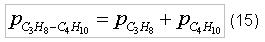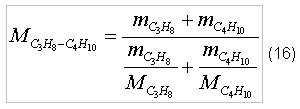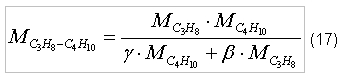Горение газовПри проектировании и эксплуатации газопламенного оборудования часто возникает вопрос об определении оптимального соотношения количества горючего и окислителя, обеспечивающего их полное сгорание с выделением максимального количества тепловой энергии. Рассмотрим методику определения оптимального соотношения количества горючего и окислителя на примере: горючий газ – метан (CH4), окислитель – кислород (O2). Реакция окисления (горения) метан/кислород: CH4+2xO2→CO2+2xH2O (1) Молярная масса одной молекулы: водорода (Н) – 1 г/моль, углерода (C) составляет 12 г/моль, кислород (O) – 16 г/моль. Тогда, молярная масса молекулы метана (CH4) составляет 16 г/моль, а молярная масса молекулы кислорода (O2) составляет 32 г/моль. Как следует из формулы (1), для полного окисления одной молекулы метана (CH4) требуется две молекулы кислорода (O2). Введем понятие стехиометрического отношения [1] окислителя к горючему (по массе):
где m – масса газа; Количество вещества определяется в молях и характеризует число структурных единиц (ими могут быть атомы или молекулы) определяемого вещества, отнесенного к числу структурных единиц (атомов) в 0,012 кг (12 гр) изотопа углерода C12. Из этого следует, что в 0,012 кг (12 гр) изотопа углерода C12 содержится один моль количества вещества. Само число структурных единиц, содержащихся в одном моле вещества, называется числом Авогадро и равно NA = 6,023x1023 моль-1 = 6,023x1026 кмоль-1 [2]. В таком случае количество вещества определяется соотношением:
где N - число структурных единиц (молекул) веществ, участвующих в реакции окисления. Как указывалось выше, в одном моле любого вещества содержится NA число структурных единиц, при этом у каждого вещества структурная единица обладает своей массой (масса атома, масса молекулы). Следовательно, массой обладает и один моль вещества, эта масса называется молярной массой. В таком случае, если вещество (в частности газ) имеет массу m, а число структурных единиц этого вещества таково, что количества вещества составляет ν, то:
Тогда, в частном случае, при сгорании метана в кислороде, можно записать:
индекс «O2» - кислород; На практике измерять массу газа неудобно и используется измерение объемов газа. Для того, что бы определить потребный объем кислорода для полного сгорания 1 м3 метана, запишем уравнение состояния [2] для каждого из газов:
где p – давление газа; Следует заметить, что в момент реакции давление и температура газов будут одинаковыми. Решим соотношения (5а) и (5б) относительно объемов соответствующих газов и определим стехиометрическое отношение кислорода к метану (по объему):
Т.к. стехиометрическое соотношение кислорода к метану для полного сгорания определено в (4), то определим следующие значения для соотношения (6):
В таком случае отношение объема кислорода к объему метана равно 2, т.е. для сжигания 1 м3 метана потребуется 2 м3 кислорода. Соотношение (6) можно записать более универсально:
Очень часто в газопламенном оборудовании в качестве окислителя используется воздух, а именно содержащийся в воздухе кислород. По данным, приведенным в [1], процентное содержание кислорода в воздухе (по массе) составляет 23,2%. Запишем соотношение:
где индекс «вз» - воздух;
Для исследования процесса горения метана в воздухе необходимо в соотношение (9б) подставить значение
тогда получим
т.е. для полного сжигания 1 кг метана требуется 17,24 кг воздуха. Для определения объема воздуха, необходимого для сжигания 1м3 метана, воспользуемся соотношением (7):
где МВЗ = 29 г/моль [1]. В общем виде соотношение (10а) примет вид:
Подставив значения в соотношение (10б), получим, что для сжигания 1 м3 метана потребуется Так же в качестве горючих газов часто используются пропан (C3H8) и бутан (C4H10). Реакция окисления (горения) пропан/кислород и бутан/кислород: C3H8 + 5xO2 → 3xCO2 + 4xH2O (11) 2xC4H10 + 13xO2 → 8xCO2+10xH2O (12) Молярные массы: пропана – MC3H8 = 44 г/моль; бутана – MC4H10 = 58 г/моль. Тогда можем записать:
Учитывая соотношение (9б), определяем, что
т.е. для сжигания 1 кг пропана необходимо 15,672 кг воздуха, а для сжигания 1 кг бутана – 15,457 кг воздуха. Используя соотношение (7) или (10б), определяем объем кислорода (O2) и воздуха, которые соответственно необходимы для сжигания 1 м3 пропана и 1 м3 бутана, что показано в таблице 1. Таблица 1. Расход окислителя на 1 кг (1 м3) горючего газа
Пропан (C3H8) и бутан (C4H10) чаще всего используются не по отдельности, а как смесь горючих газов. Поэтому требуемое количество окислителя для полного сгорания пропанобутановой смеси будет зависеть от процентного соотношения каждого из компонентов. Пусть γ - доля (по массе) содержания пропана в смеси, а β - доля (по массе) содержания бутана в смеси. γ и β подчинены следующему соотношению: γ + β=1 (13) Т.к. пропан и бутан не вступают в химические реакции, то стехиометрическое отношение для каждого из газов не будет меняться, а стехиометрическое отношение для пропанобутановой смеси в зависимости от окислителя будет определяться соотношением:
индекс «C3H8 – C4H10» – пропанобутановая смесь. Таблица 2. Стехиометрические отношения (по массе) для пропанобутановых смесей
Для того, чтобы определить отношение объема окислителя к объему пропанобутановой смеси, обеспечивающее полное сгорание, согласно соотношению (7) необходимо определить молярную массу пропанобутановой смеси - MC3H8-C4H10.
Надо учитывать, что в законе Дальтона как температура каждого из газов и их смеси, так и объем, занимаемый как отдельным газом, так и их смесью, одинаковы. Выразив давление для пропана, бутана, а так же их смеси через уравнение состояния, аналогично (5а) и (5б), можем перейти к следующему соотношению:
Учитывая, что
соотношение (16) можно переписать:
Значения молярных масс пропанобутановых смесей для наиболее используемых соотношений γ и β, приведены в таблице 3. Таблица 3. Молярные массы пропанобутановых смесей
Тогда в соответствии с соотношением (7) или (10б) можно рассчитать стехиометрические соотношения (по объему) для различных пропанобутановых смесей, что и приведено в таблице 4. Таблица 4. Стехиометрические отношения (по объему) для пропанобутановых смесей
Следует заметить, что полученные значения расхода окислителя (как по массе, так и по объему) на единицу горючего газа, следует увеличить на 2-5%, т.к. в воздухе и техническом кислороде присутствуют другие компоненты, которые под действием высоких температур горения сами вступают в реакцию окисления и тем самым снижают долю окислителя, приходящуюся на горючий газ. Так же согласно [1] и [2] закон Дальтона и уравнение состояния соблюдаются в диапазоне низких давлений. Тем не менее, большинство газопламенного оборудования используется при давлениях Газопламенное оборудование, спроектированное ООО «Машпроект» (сайт: машпроект.рф СПИСОК ЛИТЕРАТУРЫ 1. Глинка Н.Л. Общая химия – Л.: Химия, 1979. – 720 с. 2. Савельев И.В. Общий курс физики. Т. 1 – М.: Наука, 1977 – 416 с. |